小编作为一名工作将近十年的锂离子电池设计师最近开始接触锂离子电池模拟仿真领域,才感觉到什么是“山外有山,人外有人”。最近在学习的过程中看到了一篇来自1996年的文章,感受到了一场来自23年前的技术碾压。
这篇文章是由美国劳伦斯伯克利国家实验的Marc Doyle等人在1996年发表的,主要探讨了LixC6/LiyMn2O4体系的仿真研究,要知道锂离子电池在1991年才由索尼公司首次推向市场,在产品设计上仍然有许多的不足,传统的实验需要消耗大量的材料和时间,因此当时Marc Doyle等人通过计算机模拟仿真的方式提高实验效率,降低研发成本,这一研究在当时也算得上是前沿技术了。
实验中采用的体系为LixC6/LiyMn2O4,而非当时流行的LixC6/LiyCoO2,这主要是出于成本方面的考虑,电解液则采用了塑化聚合物作为支撑结构,其中填充碳酸酯溶剂和锂盐(类似目前的凝胶聚合物锂离子电池)。
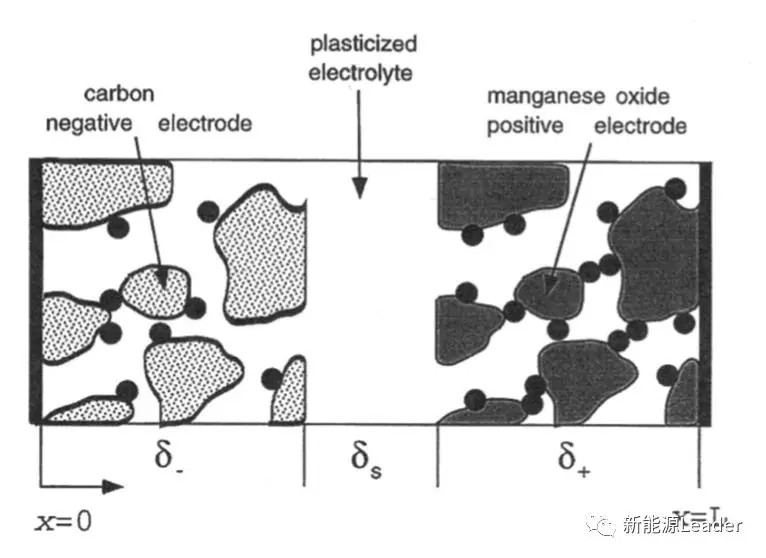
电池的结构可以用下图所示的模型进行表征,可以看到电池主要由多孔的正极、负极,液态电解质和聚合物支撑结构构成。其中电解液主要由支撑结构的聚合物、LiPF6和EC、DMC溶剂等成分构成,按照浓溶液理论,描述这样的一个复杂电解液体系则至少需要10个独立的参数,1个电导率、6个扩散系数和3个传递系数,然而在实验中测量如此多的参数是不现实的,我们仅能够获得电解液的电导率、温度和溶剂比例等参数。
根据测量,当EC/DMC=2:1,环境温度为25℃时,该电解液的电导率与盐浓度的关系可以用下式进行表达
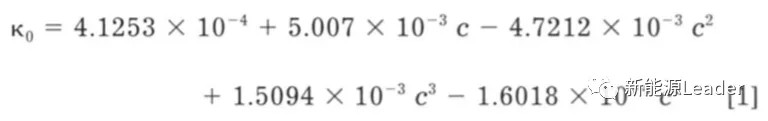
如果我们将EC/DMC的比例调整为1:2时,则电解液的电导率表达式就转变为下式,其中c为锂盐浓度,需要指出的这里的锂盐浓度指的是包含全部体积的浓度,其中起到支撑结构的聚合物占到了全部电解液体积的0.276。
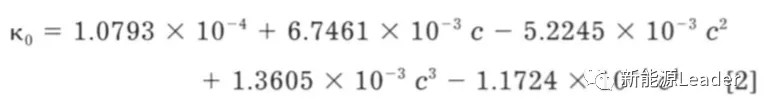
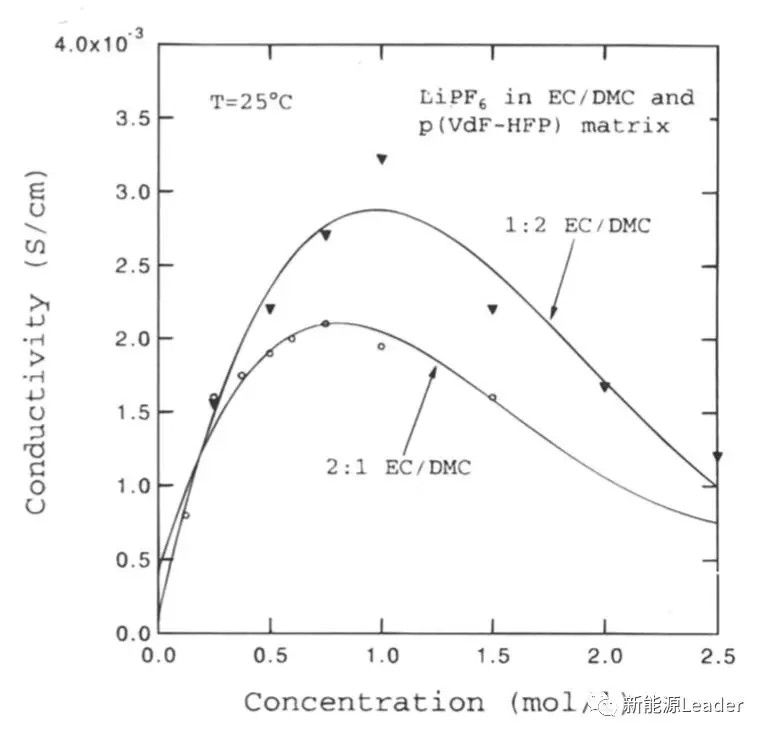
下图为根据上面的两种电导率计算公式得到的计算数据与实际实验测试得到得电解液电导率与浓度之间的关系,可以看到计算结果与实际数据复合的比较好。
在电子导电率方面我们通常认为石墨负极具有非常优异的导电性能,而正极材料为金属氧化物,因此导电性能较差,因此正极的电子导电率更多的依赖于导电剂,根据测量在25℃下,多孔正极在放电状态下的电导率为6.0×10-3S/cm,Li在氧化物电极中的扩散系数约为1.0×10-9cm2/s,而实验中采用的大阪燃气的中间相碳微球(MCMB)在当时还没有Li扩散系数数据。
全电池的热力学和动力学参数主要包含交换电流密度、每个半反应的扩散系数,电池开路电压,其中电池的开路电压测量可以采用小电流放电(60h)的方式获得。而电解液的活度系数由于难以测量,因此作者在这里假设电解液为理想溶液,而电极表面的电荷交换速度很快,而Li在电极材料中的扩散很慢,这也造成了嵌入反应的动力学参数难以测量。电池中各个材料参数如下表1和2所示。
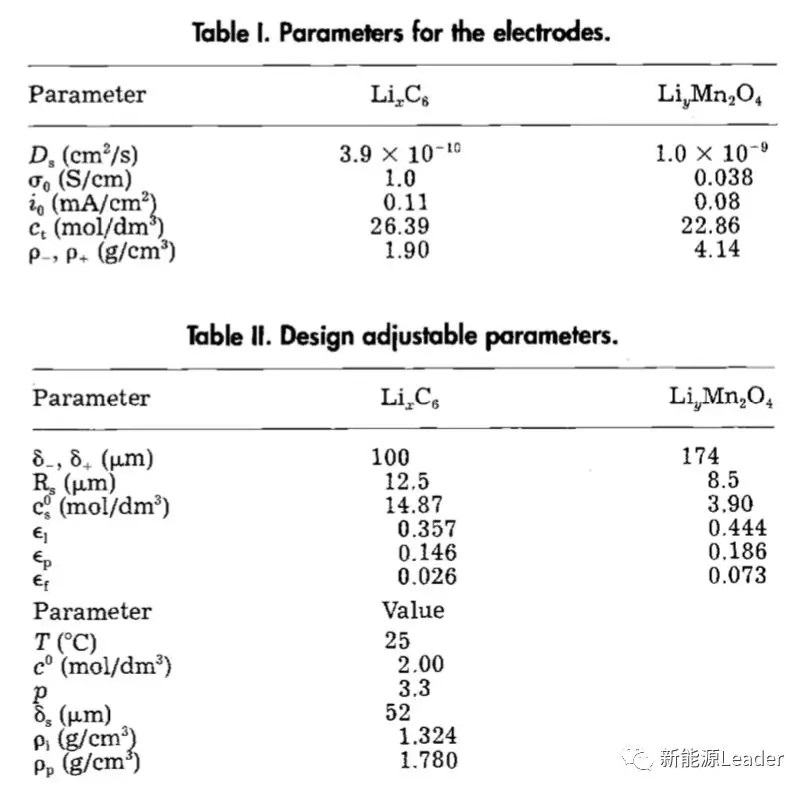
话不多说,我们直接来看模型的效果,下图为电池1在25℃时,不同倍率的放电曲线(该电池采用的电解液为2mol/L的LiPF6,溶剂配比为EC/DMC=1:2),其中下图中的点为实验数据,虚线为拟合结果,实线为拟合时考虑了锂离子电池的接触电阻(97.345Ω/cm2)。在锂离子电池中由于在首次充放电中会在负极表面发生较多的副反应,因此正、负极的初始SoC状态很难确定,因此作者通过对小电流充放电曲线进行拟合的方式获得正负极的SoC数值。
石墨负极的Li扩散系数作者也同样采用了拟合的方式获得,通过对实验数据的拟合发现当负极的扩散系数为3.9×10-10cm2/s时能够获得最好的拟合结果。从下图我们也能够看到,相比于虚线,实线的拟合效果更好,这表明考虑接触电阻能够提升模拟的准确度,而对于接触阻抗的来源,一种可能性是来自于电极与集流体之间的接触阻抗,一种可能性来自于电极的面电阻。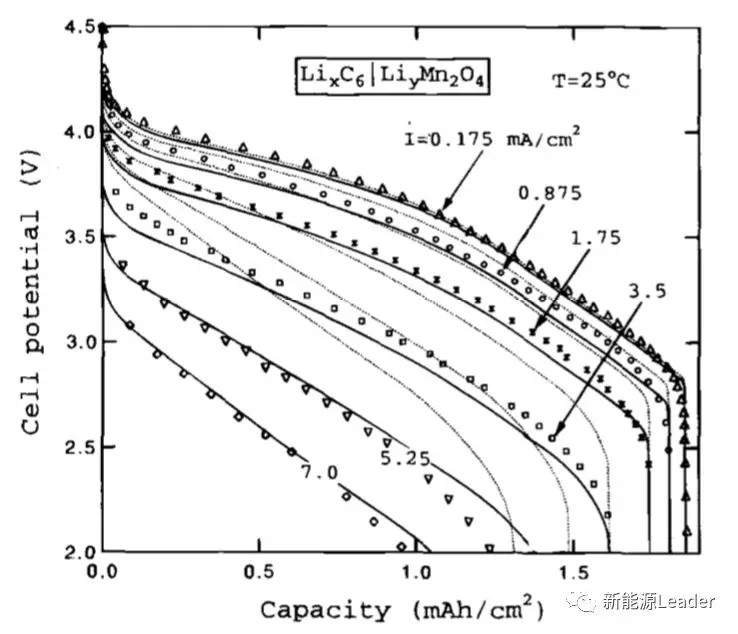
在下图中作者还验证了不同接触阻抗(900和1100Ω/cm2)对于拟合结果的影响,其中实线为接触阻抗为1100Ω/cm2时的拟合结果,虚线为接触阻抗为900Ω/cm2时的接触阻抗,从图中能够看到在阻抗为1100Ω/cm2时,在高倍率下的拟合结果准确度大大提升,在低倍率下的拟合结果稍差,这表明接触阻抗是引起锂离子电池极化的重要原因。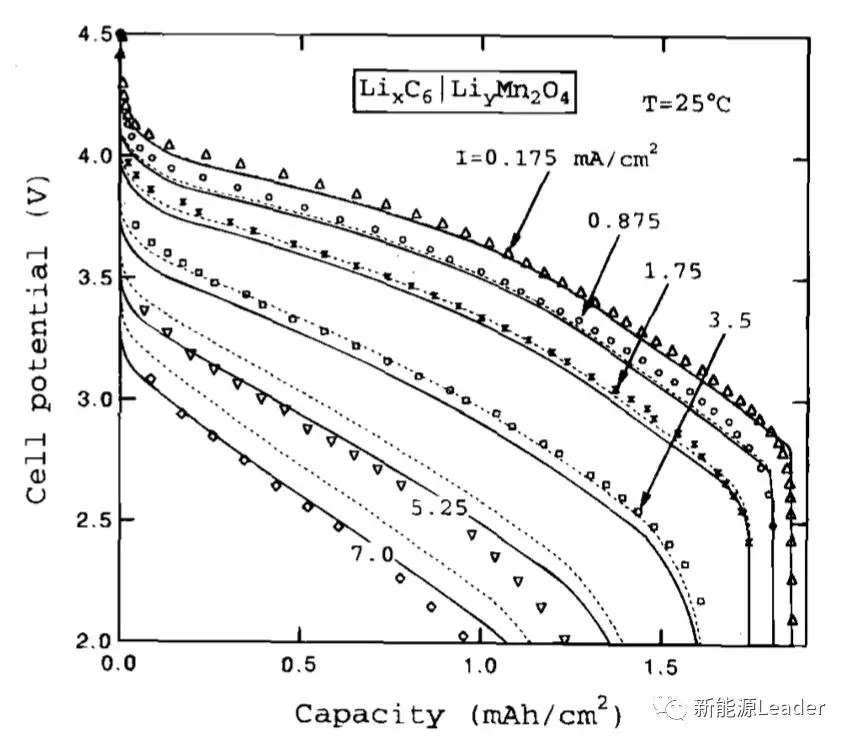
接下来,我们来看电池2的拟合效果,电池2在设计上与电池1大部分相似,仅在电极厚度和电解液配比上有区别,其中电池2的电解液为1mol/L的LiPF6,EC/DMC=2:1,电池1模拟中的参数大部分也可以直接用在电池2中,其中电池2的负极面电阻设定为700Ω/cm2,实验结果与拟合结果如下图所示。从图中能够看到对于电池2而言,仿真数据与实验数据拟合的非常好。对于电池2的拟合也同样发现欧姆阻抗和面阻抗是造成电池极化的主要原因,但是电池2由于电解液的锂盐浓度较低,因此在较大的放电倍率下还出现了浓差极化增加的情况。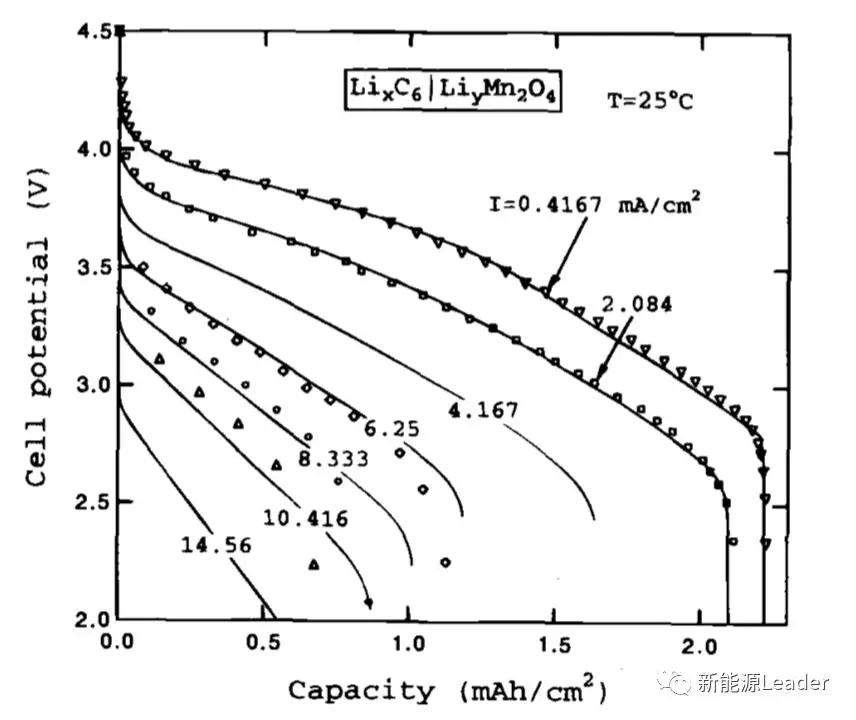
模型的好处不仅仅是对电池的表观数据(电压、电流)进行仿真,还能够让你获得一些无法通过实验得到的数据。例如下图,我们可以通过模型获得不同倍率下锂离子电池放电过程中电解液中的锂盐浓度的变化数据,从模型获得的结果可以看到在高浓度下虽然也会产生浓度梯度,但是这种浓度梯度较小,但是在较低的浓度下,我们能够发现在大电流放电时正极一侧的锂盐浓度在短时间内就下降到了0,因此在低浓度锂盐中大倍率放电时扩散限制也是引起电池极化增加的重要原因。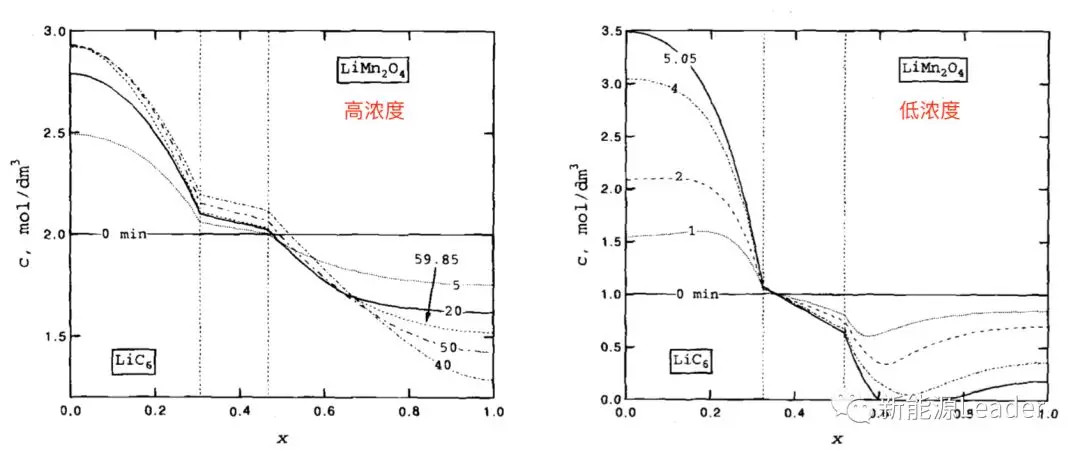 模型研究带来的好处是显而易见的,通过建立仿真模型我们不仅仅能够对于锂离子电池表观的一些电压、电流等参数进行模拟,还能够获得我们无法通过实验获得的数据,对于指导锂离子电池的设计和生产,降低工作量、提升工作效率具有重要的意义。1996年,锂离子电池刚刚商业化后数年的时间,整个锂离子电池行业还处于探索的初期,科研工作者就已经通过现在看来略显简陋的模型对锂离子电池进行了模拟仿真,对于推动锂离子电池产业的发展起到了重要的作用,而在23年后的今天,在所有的工具都已经如此完善的情况下,我们一定能够将模拟这一工具运用的更好。
模型研究带来的好处是显而易见的,通过建立仿真模型我们不仅仅能够对于锂离子电池表观的一些电压、电流等参数进行模拟,还能够获得我们无法通过实验获得的数据,对于指导锂离子电池的设计和生产,降低工作量、提升工作效率具有重要的意义。1996年,锂离子电池刚刚商业化后数年的时间,整个锂离子电池行业还处于探索的初期,科研工作者就已经通过现在看来略显简陋的模型对锂离子电池进行了模拟仿真,对于推动锂离子电池产业的发展起到了重要的作用,而在23年后的今天,在所有的工具都已经如此完善的情况下,我们一定能够将模拟这一工具运用的更好。

来源:新能源leader
本文地址:https://www.d1ev.com/news/qiye/95867
文中图片源自互联网,如有侵权请联系admin#d1ev.com(#替换成@)删除。
